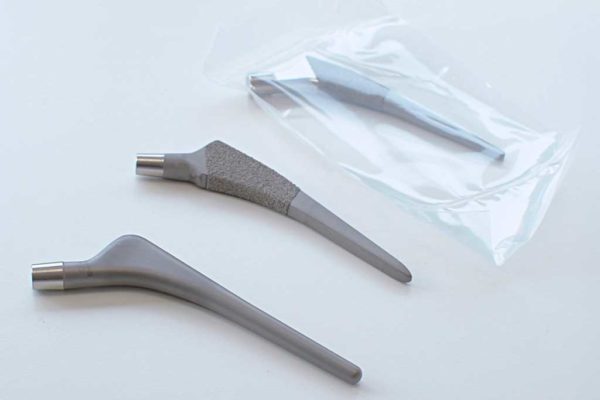
El objetivo es fabricar un recubrimiento con calidad certificada, que suponga un retorno de satisfacción, tanto para fabricantes como para el paciente final.
La importancia de la materia prima
Controlamos el 100% de la materia prima en nuestro proceso, garantizando la biocompatibilidad y ausencia de restos de materia no deseada tras el recubrimiento.
Desde el principio bajo trazabilidad y control
Realizamos todo el proceso en nuestras instalaciones asegurando la trazabilidad. Tras la recepción de las piezas realizamos nuestro propio pedido interno, donde seguimos las especificaciones y fases de cada cliente.
Embalaje de las piezas
Disponemos de una Sala Blanca con certificado ISO 7, equipada y mantenida constantemente para realizar un embalaje directo esterilizado, si el cliente lo requiere. El implante puede quedar listo para entrar directamente a quirófano.